前言
据Worldometers世界实时统计数据显示,截至北京时间2022年12月27日16时20分,全球累计确诊新冠肺炎病例662,391,407例,新增确诊327,752例;累计死亡病例6,687,583例,新增死亡为390例。
牛津大学Our World in Data统计数据显示,截至2022年12月27日,全球累计接种疫苗130.9亿剂次,全球至少接种一剂新冠疫苗的人口比例为68.7%,低收入国家仅有25.1%的人口至少接种一剂新冠疫苗。
新冠肺炎疫情仍在持续,疫苗仍是及早发现感染者、阻止病毒进一步传播扩散的有效手段。加快提升疫苗接种率,扩大疫苗覆盖人群对于疫情防控至关重要。
据了解,我国已经实现了5条技术路线研发布局的全覆盖,分别是灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗和核酸疫苗。据2022年12月29日工信部介绍,截至目前,我国已有13款新冠疫苗获批附条件上市或获准紧急使用,建成了全球最大规模的新冠疫苗生产线,年产能超过70亿剂,产量已经超过55亿剂,能够满足“应接尽接”需要。
与此同时,近3年来,我国积极主张深化疫苗国际合作,确保疫苗在发展中国家的可及性和可负担性,让疫苗成为全球公共产品。在自身人口基数巨大、疫苗供应十分紧张情况下,中国对所有向中方提出疫苗合作需求的国家都作出积极回应,为全球抗疫增添了信心和力量。
截至目前,中国已向120多个国家和国际组织供应超过22亿剂新冠疫苗,向153个国家和15个国际组织提供数千亿件抗疫物资。中国最早承诺将新冠疫苗作为全球公共产品,最早支持疫苗研发知识产权豁免,最早同发展中国家开展疫苗生产合作,中国也成为对外提供疫苗最多的国家,为全球破解“分配赤字”、弥合“免疫鸿沟”作出了重要贡献。
“疫苗分配不公是人口和工作的杀手,它破坏了全球经济复苏。”世卫组织总干事谭德塞在第75届世界卫生大会开幕式上表示。截至2022年6月10日,90%以上的非洲国家还无法实现10%人群的疫苗接种目标。而导致这些国家至今无法实现70%以上疫苗接种率,从而实现群体免疫的主要原因,就是疫苗的不足。
对于全球疫苗分配不均的严峻现实,盖茨基金会北京代表处首席代表郑志杰表示,让疫苗成为全球公共产品意味着公共、私营和慈善等不同社会部门,既要充分发挥各自的功能,又要在疫苗研发、生产和分配过程中通力合作,也就是全球公共产品的提供需要一系列多边合作机制作为一个“基础设施”。这种“基础设施”不光是“硬件”,也包括不断创新和深化的合作模式、合作机制。
第一部分:国产疫苗企业的研发生产之路
1.1 五条技术路线全覆盖
2022年3月19日下午,在国务院联防联控机制召开的新闻发布会上,国家卫生健康委科技发展中心主任郑忠伟表示,从2020年新冠疫情发生以来,我国就布局了5条技术路线的疫苗研发工作。截至目前,我国已经实现了5条技术路线临床试验的全覆盖。已经在境外开展三期临床试验的疫苗包括多款mRNA和DNA疫苗,以及腺病毒载体吸入性疫苗、减毒流感病毒载体鼻喷疫苗在内。
据21世纪经济报道记者不完全统计,截至目前,我国已有灭活疫苗、腺病毒载体疫苗、重组蛋白疫苗等13款疫苗获批附条件上市或紧急使用,3款疫苗纳入世界卫生组织紧急使用清单。
1.1.1 中国生物:3条技术路线、4款新冠疫苗
国药集团中国生物是目前全球唯一独立自主在3条技术路线(灭活疫苗、重组蛋白疫苗和mRNA疫苗)研发4款新冠疫苗的企业,四款疫苗分别为北京生物制品研究所新冠灭活疫苗、武汉生物制品研究所新冠灭活疫苗、国药中国生物研究院重组蛋白新冠疫苗及国药中生复诺健mRNA疫苗。
据中国生物公众号消息,截至目前,中国生物新冠疫苗已在全球119个国家、地区和国际组织注册上市或获批准入,接种人群覆盖196个国别,年产能超100亿剂,累计向全球生产供应35亿剂。
中国生物新冠灭活疫苗(BBIBP-CorV),其工作机制为含有无活性的新冠病毒疫苗通过肌肉注射进入人体,无活性的新冠病毒的突刺蛋白被人体免疫系统识别,并产生相应的抗体。
根据中国生物官网介绍,2020年12月9日,阿联酋卫生和预防部发布国药中生新冠疫苗III期临床试验数据,批准该疫苗成为全球首个正式注册上市的新冠疫苗。临床试验结果显示,疫苗保护效力86%,中和抗体转阳率100%,预防中度感染有效率100%,预防重症、危重症感染有效率100%;2020年12月30日,国家药监局批准该疫苗在国内首个附条件上市,审评认定其III期临床试验期中分析保护效力为79.34%;2021年4月,经过欧盟检查员严格审查,国药集团中国生物新冠灭活疫苗成为中国历史上首个在欧盟获批使用和GMP认证的疫苗产品。
中国生物两款新冠灭活疫苗分别由武汉生物制品研究所和北京生物制品研究所研制和生产,其使用的新冠病毒毒株代号分别为WIV04和HB02。2021年5月7日,中国生物北京生物制品研究所研发生产的新冠病毒灭活疫苗(Vero细胞),获得世卫组织紧急使用授权,纳入全球“紧急使用清单”(EUL)。经国务院联防联控机制有关部门组织论证,上述两款新冠病毒灭活疫苗分别于2021年7月、8月获批在我国3-17岁人群中紧急使用。
2021年5月26日,国际医学期刊《美国医学会杂志》刊登了国药集团中国生物发表的《两种新型冠状病毒灭活疫苗对成人COVID-19感染的保护效力评价》。据悉,这是全球首个正式发表的新冠灭活疫苗Ⅲ期临床试验结果,这也是中国新冠疫苗Ⅲ期临床试验结果的首次发表。研究结果显示,受试者在第0天和第21天接受两次肌肉注射。自第二剂接种后14天,累计确诊142例有效病例(铝佐剂组95例,WIV 04组26例,HB 02组21例),两种疫苗组有效率分别为72.8%和78.1%。研究结果还显示,全人群中和抗体阳转率达99%以上。安全性好,不良反应多为注射部位疼痛,程度轻。
在接受央视新闻采访时,国药集团中国生物董事长杨晓明介绍指出两款疫苗的异同:从工艺路线来说,两款疫苗都是病毒灭活疫苗;从临床数据来说,两者都达到了国家药监局的要求。
III期临床数据显示,两款疫苗的有效性分别达到79.34%和72.51%,均高于世界卫生组织要求的50%,另外两款疫苗的中和抗体阳转率都接近100%。所以从有效性、安全性数据来说,这两款疫苗在选择上应该是不分伯仲。
国药集团中国生物二代重组新冠疫苗(NVSI-06-08)是国药中生生物技术研究院/新型疫苗国家工程研究中心(以下简称“中国生物研究院”)基于自主建立的计算结构疫苗学技术平台,在第一代重组新冠疫苗(NVSI-06-07)的基础上,通过对流行株突变位点的进化规律和免疫逃逸能力进行计算分析,设计研发的第二代广谱新冠疫苗(突变集成三聚化RBD),具有独立自主知识产权。
据研发团队主要负责人、中国生物研究院院长李启明介绍,重组蛋白新冠疫苗是基于新冠病毒刺突蛋白(S蛋白)受体结合区(RBD)的天然结构特征,运用结构生物学、计算生物学自主设计研发,靶点明确,针对性强,可诱导机体产生针对性中和抗体,从而阻断病毒与受体细胞的结合,发挥保护作用。
2021年12月27日,二代重组蛋白新冠疫苗获阿联酋卫生和预防部批准紧急使用,成为全球首个获批紧急使用的二代新冠疫苗。2022年4月3日,二代重组蛋白新冠疫苗获得国家药品监督管理局颁发的临床试验批准文件。目前的研究结果显示,该疫苗安全性和耐受性良好,可激发人体产生针对原型株和主要变异株高水平的中和抗体,充分体现了重组蛋白疫苗技术路线在疫苗研发中的优势和特点。
2022年3月10日,中国生物研究院在预印本平台medRxiv在线发表的一篇文章发布了中国生物研究院二代重组新冠疫苗用于序贯加强的临床试验数据,表明对奥密克戎等变异株均显示出良好效果。
2022年4月3日,国药集团中国生物二代重组蛋白新冠疫苗获得国家药品监督管理局颁发的临床试验批准文件。
1.1.2 中国科兴新冠灭活疫苗克尔来福®
克尔来福®(CoronaVac)是一款新型冠状病毒灭活疫苗,由北京科兴中维生物技术有限公司研制,系用新型冠状病毒(CZ02株)接种非洲绿猴肾细胞(简称Vero细胞),经培养、收获病毒液、灭活病毒、浓缩、纯化和氢氧化铝吸附制成。
新冠疫情暴发以来,中国科兴新冠疫苗克尔来福®已在全球60多个国家、地区和国际组织获批使用,累计供应超过29亿剂(包括中国)。2021年6月1日,克尔来福®被世界卫生组织纳入紧急使用清单;2022年11月初,克尔来福®被世卫推荐使用年龄扩展至3岁及以上,是目前在世卫紧急使用清单中唯一被推荐在3至4岁儿童中使用的新冠疫苗。
2022年10月,《柳叶刀-感染病学》刊发的香港大学李嘉诚医学院公共卫生学院Benjamin J Cowling团队的一项研究显示,克尔来福®和另一款在港使用的mRNA新冠疫苗,均能有效降低感染后重症和死亡风险且安全。接种两剂克尔来福®后,能将60~69岁、70~79岁、80岁及以上老年人的重症/危重症风险分别降低79.3%、74.3%、58.2%,死亡风险分别降低84.3%、76.7%、63.0%。接种第三剂克尔来福®后,预防重症/危重症的有效性进一步增加,60~69岁、70~79岁、80岁及以上老年人的重症/危重症风险分别降低97.4%、95.4%、97.3%,死亡风险分别降低99%、97%、97.9%。相较两剂克尔来福®,完成加强免疫对预防重症/危重症和死亡保护效果显著增加,与在港使用的另一款mRNA新冠疫苗都提供了非常好的保护效果。
在巴西,自2020年6月以来,中国科兴与巴西布坦坦研究所开展了包括新冠疫苗Ⅲ期临床试验在内的多项临床研究。2021年年初,中国科兴生产的新冠疫苗克尔来福®获得巴西国家卫生监督局授予的紧急使用许可。截至2022年8月,中国已向巴西提供新冠疫苗半成品6.6万余升,折合成品约1.07亿剂。
在巴西1.2万名医务人员中开展的新冠疫苗克尔来福®Ⅲ期临床试验证实了疫苗的安全性和有效性,该结果获得了多国药监机构认可,为科兴新冠疫苗在我国获批附条件上市、在全球60余个国家地区获批紧急使用,以及被世卫组织列入紧急使用清单都提供了最为关键的证据;在圣保罗州塞拉纳市开展的真实世界研究(“S计划”)中,克尔来福®将该市的新冠住院和死亡人数降低95%,民众生活回归正轨;在巴西25万名接种克尔来福®孕产妇中的真实世界研究证明疫苗在该人群中有良好的安全性,不良事件发生率低于其他技术平台疫苗;与巴西布坦坦研究所的本地化生产合作有力支持了巴西的疫情防控,中国新冠灭活疫苗的质量评价体系和质量评价结果获得了巴西认可。
在南非,中国科兴与卢莫乐仕集团合作,自2021年9月起在南非开展针对6个月到17岁儿童和青少年的新冠疫苗Ⅲ期临床试验。最初试验计划招募2000名志愿者,但最终参与人数高达4500人。4500名6月龄-17岁人群中开展的新冠疫苗克尔来福®Ⅲ期临床试验,证明了疫苗在未成年人,包括在6月龄~3岁以下婴幼儿中展现出良好的安全性和免疫原性,为使用疫苗覆盖该免疫空白人群提供了可能。
中国科兴在过去三年与多国的合作伙伴共同开展新冠疫苗的研究工作,截至目前全球已有超过600项有关克尔来福®的临床或真实世界研究发表,涉及健康成年人、老年人、儿童、孕产妇、特殊健康状况人群,在海外还开展了大量涉及老年人和特殊健康状况人群(肿瘤、器官移植、透析患者,以及糖尿病、心血管疾病、肾病等慢性疾病患者等)的研究,这些研究表明老年人群和特殊健康状况人群接种克尔来福®具有良好的安全性和免疫原性,且在奥密克戎变异株流行背景下新冠灭活疫苗仍然安全有效。
1.1.3 康希诺生物腺病毒载体疫苗
克威莎®是康希诺生物开发的重组新型冠状病毒疫苗(5型腺病毒载体)。康希诺生物官网显示,克威莎®采用1剂接种方案,可大大缩短接种周期,且疫苗可在2°C至8°C 之间长期稳定储运,可大幅度降低接种管理成本。
根据年报披露,康希诺生物2021年度研发开支约8.79亿元,较2020年度(约4.29亿元)增加105.1%。其中,临床试验及测试费用支出5.86亿元,较2020年增加约3.88亿元,占研发开支的66.6%,原材料及消耗材料增加约人民币0.14亿元。
2021年12月,国际权威医学期刊《柳叶刀》公布了克威莎®的全球多中心Ⅲ期临床试验结果。数据显示,在18岁及以上健康人群中接种1剂克威莎®后安全、有效。14天后,重症保护率为96.0%,总体保护率为63.7%,达到世界卫生组织建议的新冠疫苗保护率标准,无一例与疫苗相关的严重不良反应发生。
2022年3月及7月发表在medRxiv 上的论文显示,克威莎®雾优®针对奥密克戎的中和抗体水平是灭活疫苗同源加强的14倍,重组蛋白疫苗序贯加强的6倍。而此前由江苏省疾控中心进行的临床试验数据显示,克威莎®吸入剂型用于新冠交叉加强接种,安全性与免疫原性皆优。吸入剂型加强后12个月后,受试者仍保持了较高的中和抗体水平。
2021年,克威莎®获得国家药监局附条件上市批准及境外多个国家的紧急使用授权。2022年2月,克威莎®获批准于中国作为异源加强针使用,成为首款被纳入中国序贯加强免疫接种计划的腺病毒载体疫苗,同时亦已获批准于阿根廷、马来西亚及印度尼西亚用于COVID-19的序贯加强免疫接种。年报显示,至今克威莎已进入多个大洲的不同市场,包括但不限于中国、墨西哥、巴基斯坦、匈牙利、智利、厄瓜多尔、阿根廷、马来西亚、吉尔吉斯斯坦及印度尼西亚。
受惠于新冠疫苗产品良好的市场表现,康希诺生物在报告期内成功转亏为盈。财报显示,截至2021年12月31日止年度,公司总收入增长逾23,000%至约人民币43亿元,截至2021年12月31日的总资产增长76%至约人民币119亿元。因此,期内归属于公司股东的权益和归属于公司股东的每股净资产均增长约31.7%。
2022年5月,克威莎®已被世界卫生组织(WHO)正式列入紧急使用清单(EUL),成为中国首个且唯一一个获得世卫组织紧急使用授权的创新技术路线新冠疫苗。同时,康希诺生物已在东南亚、中东、拉美等国家和地区建立起了成熟的商业服务网络和高效安全的供应配送体系,加速海外布局和发展。
2022年9月4日,康希诺生物公告,其吸入用重组新型冠状病毒疫苗(5型腺病毒载体)经国家卫生健康委提出建议,国家药品监督管理局组织论证同意,作为加强针纳入紧急使用,这也是全球首个吸入用新冠疫苗。
除了腺病毒载体疫苗,康希诺生物研制了新型冠状病毒mRNA疫苗。其临床前研究结果显示,该款疫苗可以诱导出针对多种世界卫生组织(WHO)认定的重要变异株(包括当前流行株奥密克戎)的高滴度中和抗体,广谱性更强,可以更有效地保护机体免受现有变异株的感染。
同时,康希诺生物表示,未来将充分依托包括病毒载体技术、mRNA 技术在内的核心技术平台,持续开展针对性疫苗的研究与开发。
1.1.4 中国医学科学院医学生物学研究所新型冠状病毒灭活疫苗科维福
2021年6月9日,由中国医学科学院医学生物学研究所自主研发的科维福新型冠状病毒灭活疫苗首批上市,供应国内紧急使用。
Ⅰ/Ⅱ期的临床结果显示该疫苗具有良好的安全性和免疫原性,在接种机体后能够快速诱导系统的免疫应答,全程免疫后14天中和抗体与抗S蛋白抗体阳转率分别达到96%与99.33%,能有效提供保护。所开展的交叉中和试验研究表明,该疫苗免疫机体诱导的抗体具有针对不同来源新冠流行株的交叉中和能力。
中国医科院生物所研制的新冠灭活疫苗免疫程序与同类疫苗一致,全程接种2剂,每剂间隔2至4周。目前接种年龄为18岁及以上人群。
1.1.5 智飞生物重组蛋白新冠疫苗ZF2001
重组蛋白疫苗(CHO细胞)ZF2001 (商品名智克威得,下称“ZF2001 ”)由智飞生物全资子公司智飞龙科马与中科院微生物研究所合作研发,采用重组蛋白技术路线,为首个获批的国产重组新冠病毒蛋白疫苗。
作为新冠疫苗五大技术路线之一,重组蛋白路线的疫苗产品对生产车间的生物安全等级要求低,且具备纯度高、安全性更好、能实现高产量、低成本等优势。
ZF2001于2020年6月启动临床试验,2021年3月获得国家药品监督管理局组织论证同意紧急使用,成为国内第四款获批紧急使用的新冠疫苗;同月,该疫苗在乌兹别克斯坦获得注册上市,成为国际首个注册上市的重组亚单位新冠疫苗;其国际多中心III期临床试压在乌兹别克斯坦、印度尼西亚、巴基斯坦和厄瓜多尔顺利推进。2022年2月,该疫苗获批作为新冠灭活疫苗的序贯(异源)加强针;3月2日,智飞生物发布公告称,公司从国家药监局官网查询获悉,重组新型冠状病毒疫苗(CHO细胞)获批附条件上市,适用于预防新冠病毒感染所致的疾病。
2021年8月27日,智飞生物官方发布了重组新型冠状病毒疫苗(CHO细胞)的国际多中心III期临床试验数据。数据显示,共监测到全程接种后的主要终点病例数221 例,对于任何严重程度的COVID-19 的保护效力为81.76%,达到WHO 要求的新冠疫苗有效性标准。其中对于COVID-19 重症及以上病例、死亡病例的保护效力均为100%。根据基因分型后的初步分析结果,该疫苗对Alpha 变异株的保护效力为92.93%;对Delta 变异株的保护效力为77.54%。从安全性看,总体不良事件/反应的发生率,疫苗组与安慰剂组无显著差异,安全性良好。
年报显示,目前,智飞生物已构建起多个疫苗研发平台,广泛覆盖多种疫苗开发路径,包括多糖和多糖蛋白结合疫苗技术平台、灭活疫苗技术平台、基因重组技术平台、mRNA疫苗技术平台、腺病毒载体疫苗技术平台等,已形成智飞绿竹、智飞龙科马、智睿生物医药产业园三大研产基地。为了提升新冠疫苗的可及性、可担负性,公司全力推进疫苗的WHO认证工作,助力实现疫苗分配公平,促进构建全球免疫屏障。智克威得的国际药品注册、商业化合作亦取得积极进展。
1.1.6 康泰生物新冠灭活疫苗
2021年5月14日,深圳康泰生物制品股份有限公司发布公告称,该公司研发的新型冠状病毒灭活疫苗已获批在中国紧急使用。
据康泰生物介绍,这是广东省第1个获批紧急使用的新冠疫苗。康泰生物2021年4月在耶鲁大学、冷泉港实验室、英国医学杂志联合运营的Medrxiv平台及《中华医学杂志》发表的相关研究论文显示,康泰生物新冠灭活疫苗Ⅰ、Ⅱ期临床试验中0-28天免疫程序疫苗组的活病毒中和抗体几何平均滴度(GMT)为131.7,为康复者血清中和抗体GMT49.7的2.65倍,并无3级及以上不良事件发生。
研究结果还显示:该疫苗的免疫效果持久免疫后3个月抗体阳性率为97.96%,6个月抗体阳性率仍能达到89.80%。
康泰生物新冠灭活疫苗Ⅱ期加强免疫临床研究结果显示:加强免疫1剂后能够快速诱导免疫应答,活病毒中和抗体水平最高可达基础免疫后6个月的30倍,且加强免疫后3个月活病毒中和阳性率依然为100%,抗体水平仍可达209.47,下降较为缓慢。
2022年,康泰生物与暨南大学开展合作研究,评估了康泰生物新冠灭活疫苗在增强特异性抗体和细胞免疫后对当前主流突变体的保护作用。结果显示,使用康泰生物新冠灭活疫苗加强免疫后,原生型或Delta-和Omicron特异性中和抗体和细胞免疫均呈现不同程度的上升趋势,加强免疫后第7天、50天,针对突变表位特异性的CD8T细胞可以达到新冠康复者7天和50天的水平。
在保护效力方面,在终点病例基因分型结果中92.29%为Omicron株的情况下,该疫苗Ⅲ期临床保护效力达到WHO要求的大于50%的新冠疫苗有效性标准,对重型及以上病例、死亡病例的保护效果均为100%。
1.1.7 丽珠集团重组蛋白疫苗V-01
丽珠集团的V-01是一款重组蛋白疫苗,由干扰素、Pan表位、RBD二聚体、Fc融合蛋白四部分组成。由于V-01抗原结构中,融合了作为生物佐剂的人源干扰素,存在增强病毒中和抗体水平和细胞应答的可能。
已完成序贯加强Ⅲ期临床试验的中期主数据分析,并获得了关键性数:V-01序贯加强对于Omicron感染导致的COVID-19可产生良好的保护力,序贯加强后的绝对保护力为61.35%。同时,未发现有值得关注的安全性问题。
据了解,V-01自 2020 年7月开始立项研发, 于2021年年初获国家药品监督管理局批准进行临床试验,适应症为预防新型冠状病毒感染所致疾病。此前,V-01的II期临床试验数据已于《中华医学杂志》发布,显示该疫苗具有较好的安全性和免疫原性。全球多中心基础免疫及序贯加强免疫的两种方案的III期临床试验于2021年8月和2021年10月分别在菲律宾与巴基斯坦启动。
V-01 为重组蛋白疫苗,可在 2-8°C冷链运输及长期储存。V-01也是丽珠单抗与中国科学院生物物理研究所合作研发的创新型新冠重组蛋白疫苗,属于新冠疫苗五条技术路线中的重组蛋白疫苗技术路线。
V-01拥有自主知识产权,借助中科院高新技术转化的优秀疫苗平台技术,丽珠单抗可快速研发针对变异株病毒的疫苗。V-01独特的创新分子设计,使得疫苗更具优良的免疫原性和安全性,V-01作为加强针接种,序贯加强免疫效果好;另外,V-01的生产已实现原材料国产化,原材料供应链稳定,储备充足,可持续稳定大量供应。
根据试验结果,V-01序贯加强后与两针灭活疫苗对比,V-01序贯加强后的绝对保护力为61.35%,具有显著强优效性,已满足世界卫生组织(WHO)标准。
2022年9月2日,丽珠集团公告称,经国家卫健委提出建议,国家药监局组织论证同意丽珠集团重组新型冠状病毒融合蛋白疫苗(V-01)作为加强针纳入紧急使用。
2022年12月,在发表的一项研究数据表明,受试者在三针灭活新冠疫苗基础上,第四针序贯加免V-01 重组融合蛋白疫苗后14天,对BA.5的中和抗体滴度比值(与灭活苗自身加免相比)为8.5倍(136 vs. 16),是加免前的17.1 倍。显示出V-01重组融合蛋白疫苗对原型株和Omicron各亚型等新出现的关注变异株(VOC)具有显著的交叉中和免疫反应。
1.1.8 三叶草重组蛋白疫苗SCB-2019
重组蛋白新冠疫苗SCB-2019(CpG 1018/铝佐剂)(下称“SCB-2019”)是三叶草生物(02197.HK)的核心产品,也是该公司首个新冠候选疫苗。SCB-2019是一款基于Trimer-Tag TM 技术平台研发出的三聚体重组蛋白新冠候选疫苗,可在标准的冰箱冷藏条件下保持长期稳定,运用两剂接种方案,采取肌肉注射的方式,目前临床试验已达到疫苗保护效力的主要终点及次要终点。从产能看,三叶草生物规划新冠疫苗年产量达10亿剂。
1月21日早间,三叶草生物发布公告表示,当日《柳叶刀》刊登了SCB-2019的最终保护效力数据。研究显示,接种两剂SCB-2019可对重组新冠病毒(SAR-CoV-2)变异株造成任何严重程度的COVID-19提供显著保护效力。预防任何毒株引起的重度和需住院治疗的新冠肺炎(COVID-19)保护效力为100%,预防任何毒株引起的中度至重度新冠肺炎的保护效力为83.7%,预防任何毒株引起的任何严重程度的新冠肺炎的保护效力为67.2%。从病毒变种看,预防因三种主要变种引起的任何严重程度COVID-19的疫苗效力分别为78.7%(德尔塔变种)、91.8%(伽马变种)及58.6%(缪变种)。效力分析的随访期间并未出现安全问题,各组发生不良事件的比率相当。
在序贯加强针的推进背景下,SCB-2019的异源加强试验也取得了初步数据。巴西开展的一项2期临床试验初步显示,在既往已接种两剂阿斯利康疫苗的个体中,接种一剂SCB-2019加强针的中和抗体水平是接种一剂阿斯利康新冠疫苗加强针的高出至少三倍。此外,同源加强的试验数据也即将出炉。据三叶草发布的公告,SPECTRA试验于2022年1月修订后,开始将SCB-2019作为同源加强剂进行评估试验。II期临床试验2021年11月在巴西开始,初步结果预计于2022年上半年发布。
根据2021年年报,为促进新冠疫苗的公平分配和保护全球社区,三叶草生物已与流行病防范创新联盟(CEPI)、Dynavax、全球疫苗免疫联盟(GAVI)、联合国儿童基金会(UNICEF)及泛美卫生组织(PAHO)建立伙伴关系,将共同为全世界受新冠疫情影响的国家提供安全有效的新冠候选疫苗。具体而言,CEPI于2021年多次增加对SCB-2019的潜在资金承诺;公司于2021年6月30日与GAVI签订了一项预购协议,将向COVAX机制 3 提供最高达4.14亿剂疫苗以供全球分配;公告显示,三叶草生物旗下公司已与联合国儿童基金会(UNICEF)签订长期疫苗供应协议,约定2022年向COVAX“新冠肺炎疫苗实施计划”提供4.14亿剂SCB-2019疫苗。
“我们期待通过COVAX机制提供我们的新冠候选疫苗,以支持新冠疫苗的公平获取。迄今为止,在低收入国家只有不到15%的人群获得了新冠疫苗,我们期望提升新冠疫苗的公平获取,并帮助世界各地亟需的人群。”三叶草生物首席执行官梁果表示。
2022年12月4日,三叶草生物发布公告称,其新冠疫苗SCB-2019(CpG 1018╱铝佐剂)已获中国有关部门评估并在中国被纳入紧急使用。
同时,对于更广泛的新冠疫苗项目,三叶草表示,将继续应用Trimer-Tag™技术平台研制变异株特异性的新冠疫苗,例如二代新冠候选疫苗SCB-2020S (CAS-1)。其目标是商业化优质的候选疫苗,使其针对当下及未来的变异株具有安全性和广谱保护效力。
1.1.9 万泰生物鼻喷新冠疫苗
鼻喷苗采用经特别改造以提高安全性和有效性的双重减毒甲型流感病毒作为载体,插入新冠病毒刺突蛋白RBD基因片段研制而成。
流感病毒具有与新冠病毒(尤其是奥密克戎变异株)高度重叠的从鼻腔开始的全呼吸道易感细胞解剖分布特点,因此该疫苗通过鼻腔喷雾方式接种可以模拟病毒自然感染方式在呼吸道形成预防新冠病毒入侵的第一线免疫屏障,且与肌肉注射式新冠疫苗诱导全身性保护的机制彼此互补,有利于形成更全面的保护。
研究显示鼻喷苗可诱导包括细胞免疫、体液免疫、固有免疫和训练免疫等多维度保护性免疫应答从而发挥广谱保护效果,因此基本不受病毒抗体逃逸突变的影响,对原型株或是包括奥密克戎BF.7、XBB、BQ.1.1变异株在内的迄今各主要变异株的保护性免疫应答强度相当。
鼻喷苗三期临床试验是全球第一个黏膜免疫新冠疫苗的随机对照保护效力试验,在菲律宾、南非、越南和哥伦比亚等国入组了31038名18-91岁志愿者。
临床试验数据显示,无论作为基础免疫还是序贯加强免疫,鼻喷苗对奥密克戎变异株感染导致的新冠病毒病(COVID-19)具有良好保护效果:
(1)对住院及以上严重疾病的保护效力为100%;
(2)在既往无其它新冠疫苗免疫史人群中,对症状较明显病例(具有3个及以上新冠相关症状)的保护效力为67%;对包括仅有轻微症状者在内的所有症状性感染的保护效力为55%;
(3)在既往有新冠灭活疫苗免疫史的人群中,序贯加强鼻喷苗与用安慰剂加强相比,对症状较明显病例的相对保护效力为63%。
12月2日,经国家卫生健康委提出建议,国家药品监督管理局组织论证同意,由厦门大学、香港大学、万泰生物联合研发的鼻喷流感病毒载体新冠肺炎疫苗获批紧急使用。
1.1.10 神州细胞新冠病毒2价(Alpha/Beta变异株)S三聚体蛋白疫苗SCTV01C
SCTV01C是神州细胞工程针对新冠病毒变异快、以原始株为基础的国内外第一代疫苗对变异株中和抗体滴度和保护率下降等问题自主研发的新一代2价变异株重组蛋白疫苗,临床上拟用于预防新型冠状病毒感染所致疾病(COVID-19)。SCTV01C的活性成分分别包含两种WHO认定的主要变异株阿尔法(Alpha)和贝塔(Beta)的重组S三聚体蛋白抗原,并采用比传统铝佐剂更能显着增强Th1细胞的水包油新型佐剂。
SCTV01C于2021年11月获得国家药品监督管理局的应急批准进行临床试验,截至目前已在境内外开展多项临床研究并取得部分期中分析及免疫持久性分析结果。
已有临床前及临床研究数据显示,SCTV01C与灭活苗接种后的安全性高度相似;在免疫原性方面,针对当前流行的奥密克戎(Omicron)BA.1和BA.5变异株均能诱导出均一的、超高的真病毒中和抗体滴度,分别达到了对比灭活苗的预设优效终点指标和对比辉瑞mRNA疫苗的预设非劣终点指标,展示出了突出的广谱交叉保护优势和对未来可能出现的新变异株的高效防感染潜力;此外,使用SCTV01C进行加强免疫后12个月时中和抗体滴度值仍可维持在170-678的较高区间,展示出SCTV01C突出的免疫持久性。
12月4日,神州细胞发布公告表示,公司控股子公司神州细胞工程有限公司收到国家相关部门的函件,公司自主研发的重组新冠病毒2价(Alpha/Beta变异株)S三聚体蛋白疫苗(项目代号:SCTV01C)经国家有关部门论证被纳入紧急使用。
1.1.11 威斯克生物重组新型冠状病毒疫苗(Sf9细胞)威克欣
12月5日消息,据四川大学官网、四川大学华西医院官网及成都威斯克生物医药有限公司(以下简称“威斯克”)官方微信公众号发布的消息,近期,国家相关部门已批准成都威斯克生物医药有限公司/川大华西研发的重组新型冠状病毒疫苗(Sf9细胞)威克欣纳入紧急使用。
据悉,威克欣是中国首个获批紧急使用的昆虫细胞技术平台生产的重组蛋白新型冠状病毒疫苗。
数据显示,威克欣能够明显诱导针对新冠病毒原型株及变异株的中和抗体,并且在现有新冠疫苗接种的基础上序贯加强免疫能获得更强的免疫反应。
公告称,在制备技术上,威克欣使用国际上先进的生产技术,将新冠病毒的基因引入昆虫细胞,制备新冠病毒S蛋白,诱导人体产生抗体阻断病毒感染,已实现大规模生产。利用昆虫细胞生产重组新冠蛋白疫苗,不仅蛋白表达质量好,而且安全性很高。目前该技术路线在国际上已应用于疫苗生产,且有流感疫苗与宫颈癌疫苗的重组蛋白疫苗等产品上市。
1.2 国产疫苗助力全球抗疫
从疫苗援助和出口,到共同开展临床试验,再到合作生产疫苗,中国始终以实际行动推进疫苗国际合作。
据新华社消息,2021年以来,中国开启以疫苗合作为重点的抗疫合作下半场。在2022年6月14日上午举行的相关新闻发布会上,外交部副部长马朝旭表示,截至2022年5月,中国累计向153个国家和15个国际组织提供了46亿件防护服、180亿人份检测试剂、4300余亿个口罩、22亿剂新冠肺炎疫苗等抗疫物资。
2021年6月,中方同28国共同发起“一带一路”疫苗合作伙伴关系倡议,倡导加强疫苗援助、出口、联合生产等合作,呼吁开展开放、公平、非歧视的国际疫苗合作。
2021年7月29日,中国外交部国际经济司会同国药、科兴、康希诺、智飞龙科马4家疫苗企业,共同主办了新冠疫苗合作企业对话会,来自20多个国家的30多家疫苗企业参与会议并讨论了新冠疫苗贸易和联合生产等问题,表示将承担企业社会责任,携手推进新冠疫苗的国际合作,进一步扩大疫苗供应,为抗疫国际合作作出更大贡献。
2021年8月5日,新冠疫苗国际合作论坛成功举办,与会各国达成全年超过15亿剂的合作意向,论坛期间,中国还同22个国家共同发表了《新冠疫苗合作国际论坛联合声明》,进一步推动加强疫苗国际合作。
2021年10月30日,中国方面指出,正同16个国家开展疫苗联合生产,初步形成7亿剂的年产能。中国还同30个国家一道发起“一带一路”疫苗合作伙伴关系倡议,呼吁国际社会共同促进疫苗全球公平分配。
2022年3月22日,金砖国家疫苗研发中心启动仪式上,金砖国家疫苗研发中心五国各国别中心共同提出《加强疫苗合作,共筑抗疫防线》的倡议,将疫苗作为全球公共产品公平合理分配,保障疫苗在发展中国家的可及性与可担负性,同时表示将加强联合研发,提升金砖国家传染病防控能力以及应对公共卫生事件的能力。
据人民日报报道,为推进新冠疫苗国际合作、促进疫苗公平可及,中国还开展“中国—东盟疫苗之友”合作,并愿依托该机制打造区域疫苗生产和分配中心;构建中国—中亚卫生健康共同体,打造全方位疫苗伙伴关系。
中国与埃及、厄瓜多尔、墨西哥等国积极开展疫苗联合生产合作。2020年12月,中埃两国签署《中埃关于新冠病毒疫苗合作意向书》。签署协议仅半年,中国新冠疫苗在埃本地化生产项目正式灌装投产。2021年7月18日,中国—埃及新冠疫苗合作生产项目实现100万剂量产。
据央视2021年7月6日报道,埃及总理穆斯塔法•马德布利宣布,目前埃及已完成了首批100万剂中国科兴疫苗的生产,目前日产量已达到了30万剂,如果原材料充足,日产量可达60万剂。马德布利还表示,目前新冠疫苗在全球范围内供不应求,因此本地化生产新冠疫苗对埃及至关重要。
数据显示,截至目前,厄瓜多尔已收到2200多万剂中国新冠疫苗,中国疫苗约占厄瓜多尔接收疫苗总量的53%。据新华社报道,厄卫生部数据显示,目前在厄瓜多尔进行接种的新冠疫苗大部分是科兴疫苗,此外还有中国康希诺疫苗、美国辉瑞疫苗和英国阿斯利康疫苗。截至2022年2月底,该国超过1351万人完成新冠疫苗接种,约占全国目标接种人口的84%。
关于中国对外的抗疫援助,在2021年5月21日举行的全球健康峰会上,中国提出,在产能有限、自身需求巨大的情况下,中国履行承诺,向80多个有急需的发展中国家提供疫苗援助,向43个国家出口疫苗。中国已为受疫情影响的发展中国家抗疫以及恢复经济社会发展提供了20亿美元援助,向150多个国家和13个国际组织提供了抗疫物资援助,为全球供应了2800多亿只口罩、34亿多件防护服、40多亿份检测试剂盒。
据12月19日《人民日报》报道,截至目前,中国已向120多个国家和国际组织供应超过22亿剂新冠疫苗,向153个国家和15个国际组织提供数千亿件抗疫物资。
第二部分:疫苗出海
在4月20日举行的博鳌亚洲论坛2022年年会期间,国家国际发展合作署副署长邓波清表示,近年来,我国倡导并积极践行“全球疫苗合作行动”,最早承诺将新冠疫苗作为全球公共产品,最早支持疫苗知识产权豁免,最早同发展中国家开展疫苗生产合作。截至2022年6月底,中国已经向120多个国家和国际组织提供超过22亿剂新冠疫苗,超过100个国家批准使用中国生产的疫苗。中国已相继向20多个国家转让技术并合作生产疫苗,在海外形成了10亿剂的新冠疫苗年产能。
2.1 疫苗出口
据不完全统计,目前全球20多个国家已与中国签署新冠疫苗订购协议,还有多国有购买意向。其中,阿联酋、埃及、巴林等多国已经正式批准使用中国疫苗。
2020年12月30日,乌克兰卫生部与中国科兴签署新冠疫苗采购合同,中方将向乌方提供191万剂新冠疫苗。同日凌晨,土耳其从中国科兴公司订购的首批300万剂新冠疫苗运抵首都安卡拉。根据计划,第一阶段将有900万人接种疫苗,接种对象主要是医护人员等高危人群。
2021年1月,匈牙利签署了500万剂新冠疫苗采购合同,成为首个批准使用中国国药新冠疫苗的欧盟国家。2021年1月3日,泰国卫生部发表公报称,泰国已与中国科兴公司签署新冠疫苗订购协议,采购200万剂新冠疫苗。2021年1月6日,秘鲁总统萨加斯蒂在向全国发表电视讲话时宣布,秘鲁已与中国国药集团达成购买该集团生产的新冠灭活疫苗协议,首批100万剂疫苗将于本月抵达秘鲁。2021年1月12日,马来西亚大型国有制药企业发马公司与中国科兴公司签订新冠疫苗合作协议。根据协议,科兴公司将逐步向马来西亚提供1400万剂新冠疫苗半成品,与发马公司合作在马来西亚本土完成疫苗最终生产。2021年8月16日,孟加拉国卫生和家庭福利部以及孟加拉国伊思达疫苗有限公司与中国国药集团签署新冠灭活疫苗合作备忘录。2021年12月22日,缅甸工业部与国药集团中国生物签署新冠疫苗半成品供应协议。
中国积极推进国际抗疫合作,至今已向全球120多个国家和国际组织提供22亿剂疫苗。其中,中国科兴通过直接出口疫苗成品或出口半成品本地化生产,累计向海外供应新冠疫苗克尔来福®超11亿剂,是出口量最大的中国新冠疫苗。克尔来福®已在中国、智利、巴西、哥伦比亚、印尼、柬埔寨、中国香港等14个国家和地区获批在儿童和青少年人群中使用,其中智利和香港地区使用年龄还扩展至6月龄以上。
另据媒体报道,全球疫苗免疫联盟此前宣布,已同中国国药集团和科兴公司分别签署预购协议,意味着国药疫苗和科兴疫苗进入“新冠肺炎疫苗实施计划”疫苗库,将为发展中国家的疫情防控贡献更大力量。
为进一步支持各国抗击疫情、全面扩大疫苗国际合作,2021年6月22日,商务部等4部门发布公告,将国药中生北京公司、北京科兴中维公司、康希诺公司、国药中生武汉生物制品研究所有限责任公司的4款已在国内获批附条件上市的疫苗列入可供对外出口的新冠疫苗产品清单,并表示支持列入清单的中国疫苗生产企业以自营方式组织出口,清单将根据国家药监局审批上市情况适时动态调整。
2021年7月13日,在国新办新闻发布会上,海关总署新闻发言人、统计分析司司长李魁文介绍,2021年上半年,中国已向112个国家和地区出口了超5亿剂新冠疫苗和原液,中国向全球供应的疫苗和原液已相当于当前全球疫苗总产量的1/6。
据中商产业研究院数据,截至2021年11月,我国5款新冠疫苗已在100多国获批使用,累计出口量超过18亿剂,累计出口额超过900亿元。
从地域看,国产新冠疫苗的主要出口地位于东南亚及中东地区。根据海关总署的统计数据,按照疫苗出口货值由大到小的顺序排列,2021年全年前五大疫新冠苗出口国依次为印度尼西亚、巴基斯坦、阿联酋、巴西及土耳其。
2.2 合作开展临床试验
在积极推动疫苗出海之际,中国还与阿联酋、埃及、印尼、土耳其、巴西等发展中国家开展新冠疫苗联合研发和合作生产,与海外国家合作开展Ⅲ期临床试验。据新华社报道,我国已有46款新冠病毒疫苗进入临床试验,21款在境外获批开展Ⅲ期临床试验。据21世纪经济报道记者不完全统计,截至2022年12月28日,我国已有灭活疫苗、腺病毒载体疫苗、重组蛋白疫苗等13款疫苗获批附条件上市或紧急使用,3款疫苗纳入世界卫生组织紧急使用清单。
巴西国家卫生监督局2021年7月14日宣布,批准在巴西对由中国医学科学院医学生物学研究所自主研发的科维福新冠病毒灭活疫苗进行Ⅲ期临床试验。同年4月,巴西批准由中国三叶草生物制药有限公司研发的一款新冠疫苗在该国进行Ⅱ期和Ⅲ期临床试验;2020年7月,由中国科兴研制的新冠疫苗克尔来福在巴西开展Ⅲ期临床试验。
2020年12月,由中国科学院微生物研究所和智飞龙科马公司共同研发的新冠疫苗在乌兹别克斯坦启动国际Ⅲ期临床试验。2021年3月,乌兹别克斯坦相关部门完成对该款疫苗的注册,授予该疫苗在乌境内紧急使用和销售许可,疫苗运抵后被分配到该国疫苗接种点,为民众实施大规模接种。
2021年6月,国家卫生健康委副主任、国务院联防联控机制科研攻关组疫苗研发专班负责人曾益新接受新华社记者专访时介绍指出,我国在新冠疫苗研发、生产、使用等方面均在积极开展国际合作。研发方面,部分疫苗研发单位已经与阿联酋、巴西、乌兹别克斯坦、菲律宾、巴基斯坦等20余个国家的相关机构合作开展Ⅲ期临床试验。生产方面,部分企业生产的原液已运往巴西、印度尼西亚、埃及、阿联酋、巴基斯坦、马来西亚等国,并启动境外分包装工作。
2.3 合作推进疫苗生产本土化
据不完全统计,截至目前,中国已向120多个国家和国际组织供应超过22亿剂新冠疫苗,在15个国家已经或正在建设疫苗原液灌装基地,打造当地疫苗生产中心,并向有疫苗合作需求的国家提供相应技术支持。
具体而言,如中国生物与阿联酋、塞尔维亚、摩洛哥、缅甸等国,中国科兴与巴西、南非、埃及、智利等国与当地企业开展紧密合作,康希诺生物与墨西哥等积极开展疫苗生产合作。
2.3.1 中国生物
截至目前,中国生物新冠疫苗已在中国、阿联酋、巴林、玻利维亚、塞舌尔、泰国、土库曼斯坦、马来西亚、秘鲁等10个国家注册上市,经119个国家和地区及国际组织批准紧急使用或市场准入,接种人群已覆盖196个国别,完成了中国80%以上援外疫苗供应任务,全球50多个国家元首和政府元首接种了国药集团中国生物新冠疫苗。其中向非洲和拉美州59个国家及国际组织供应新冠疫苗2.9亿剂,援助49个非洲、拉美州国家及国际组织,践行了中国新冠疫苗作为全球公共产品的庄严承诺。中国生物全系统新冠疫苗年产能达100亿剂。
中国生物围绕“可诊、可治、可防”三个方面,率先研发出4款新冠诊断试剂,4款新冠特效治疗药物,独立自主在三条技术路线上成功研发4款新冠疫苗。针对奥密克戎变异株研发的奥株灭活疫苗、第二代重组蛋白新冠疫苗均获得临床批件,奥株mRNA疫苗也已提交临床申请。
2021年3月28日,中国和阿联酋合作的中国新冠疫苗原液灌装生产线项目“云启动”仪式,在中国北京、河北和阿联酋阿布扎比三地同步举行。阿联酋本土从此拥有第一款新冠疫苗,名为“生命之苗”。据路透社报道,这家疫苗工厂是中国国药集团与阿布扎比科技公司“Group 42”(G42)的合资公司。2021年3月29日,该公司发表了一份声明透露,疫苗工厂拥有3条灌装线和5条自动包装线,疫苗年生产量将达到2亿剂。
2021年9月9日,欧洲地区首家中国疫苗工厂的奠基仪式在塞尔维亚首都贝尔格莱德举行。根据塞尔维亚总统府发表的声明,这家工厂将于2022年4月开始生产中国国药新冠疫苗,除保证塞尔维亚需求外,还将供应巴尔干及欧洲地区其他国家。
塞尔维亚总统武契奇在工厂奠基后表示,在中国和阿联酋伙伴的帮助下,塞尔维亚将建设一家现代化疫苗工厂,这对塞乃至本地区的抗疫行动具有重要意义。中国疫苗工厂“是友谊的证明”。
据“中国生物”微信公众号消息,2021年7月5日,中国生物、国药国际与摩洛哥卫生部共同签署新冠灭活疫苗合作备忘录,启动在新冠疫苗原液分装等方面的深入合作。此次,国药集团中国生物新冠灭活疫苗将与摩洛哥Sothema公司展开生产合作,利用现有无菌灌装线每月可生产500万剂新冠疫苗,摩洛哥卫生部将对生产过程进行监督指导。
报道称,摩洛哥方面在合作签约仪式致辞中表示,摩洛哥是首个决定通过为民众接种疫苗以实现群体免疫的国家,目前疫苗接种率达到34%。此次与国药集团开展的新冠疫苗分装合作,将助力摩洛哥实现产能供应,推动摩洛哥创建非洲生物制药和疫苗创新中心,服务非洲大陆乃至全球。2021年12月22日,缅甸工业部与国药集团中国生物签署新冠疫苗半成品供应协议。在摩洛哥和缅甸,疫苗分装顺利展开,新冠灭活疫苗已经进入千家万户。
据“中国生物”微信公众号消息,中国生物与阿联酋G42集团合作建设的疫苗生产基地预计今年内完工,建成后将是阿联酋乃至中东地区最大的多品种疫苗制剂和仓储配送中心。欧洲地区首个中国疫苗工厂也在塞尔维亚首都贝尔格莱德紧张建设中,产品将满足塞尔维亚本国及周边国家需求。
为了确保疫苗的可及性,国药集团中国生物先后建成6个P3高等级生物安全生产车间,3个P3高等级生物安全实验室,新冠疫苗总体年产能持续放大,成为全球最大新冠疫苗研发生产基地和最大供应商。
2.3.2 中国科兴
中国科兴的新冠灭活疫苗已在60多个国家、地区及国际组织获批使用,在14个国家和地区获批未成年人使用,累计向全球提供近29亿剂。该疫苗也是全球唯一获批用于6月龄儿童的新冠灭活疫苗。
中国积极推进国际抗疫合作,至今已向全球120多个国家和国际组织提供22亿剂疫苗。其中,中国科兴通过直接出口疫苗成品或出口半成品本地化生产,累计向海外供应新冠疫苗克尔来福®超11亿剂,是出口量最大的中国新冠疫苗。
过去三年,中国科兴积极与巴西、智利、哥伦比亚、埃及、阿尔及利亚、印度尼西亚、马来西亚、土耳其等国的合作伙伴开展本地化生产合作。通过出口疫苗半成品到这些国家,由当地的合作伙伴灌包装成疫苗成品的方式,在短时间内实现了巨大产能,从而更好地满足各国疫苗供应需求,极大增加了中国新冠疫苗在更多国家的可及性和可担负性。
截至目前,中国科兴新冠疫苗已在非洲20多个国家、地区供应。2021年,5月21日,埃及从中国采购的首批科兴新冠疫苗半成品运抵开罗。中国科兴和当地医药企业VACSERA合作,在埃及生产新冠疫苗克尔来福®。中国科兴不仅向埃方提供原液,还派出技术人员对疫苗的灌装、包装进行技术指导,使埃及成为非洲第一个能自主生产新冠疫苗的国家。在亚洲,印尼当地国有制药企业Bio Farma也已与科兴达成联合生产协议。在拉美,中国科兴和巴西布坦坦研究所合作生产研发疫苗。
据中国科兴官方公众号“疫苗之益”消息,2021年12月,中国科兴收到了来自厄瓜多尔政府本地联合建厂的邀请。2022年2月23日,厄瓜多尔卫生部在首都基多与中国科兴公司签订合作意向书,双方同意在厄建设一所生产新冠以及其他疫苗的工厂。
2.3.4 康希诺生物
从疫苗供应到联合生产,康希诺生物采取行动推进疫苗出海。据媒体报道,截至目前,康希诺生物新冠疫苗已获得巴基斯坦、墨西哥、厄瓜多尔、智利、阿根廷、匈牙利、吉尔吉斯斯坦、印度尼西亚、马来西亚等、阿联酋、摩洛哥等多国授予的紧急使用授权或附条件上市批准。此外,康希诺生物还以技术转让的方式助力巴基斯坦、墨西哥、马来西亚等多个发展中国家实现新冠疫苗本地化生产,拓展疫苗海外联合生产。
通过与中国企业的合作,墨西哥实现了疫苗本土化生产。2021年10月,墨西哥制药公司Drugmex董事会主席在接受人民日报采访时介绍称,目前,在墨西哥中部克雷塔罗州新冠疫苗工厂内,有上百名墨西哥员工进行康希诺生物新冠疫苗的灌装生产,另有一个40人的团队负责行政和监管工作。从2021年3月首批中国康希诺生物的新冠疫苗完成灌装至今,已应用于墨西哥等拉美国家市场。
据了解,当地时间2021年2月9日,康希诺生物新冠疫苗获得墨西哥药品监督管理机构的紧急使用授权。此前,康希诺生物与墨西哥卫生部签署预购框架协议,计划向墨西哥供应重组新型冠状病毒疫苗(腺病毒载体)克威莎®。该疫苗是本次墨西哥政府合作方中唯一采用单针免疫的疫苗,数千万名墨西哥民众将获得免疫保护。
据新华社报道,2022年5月4日,康希诺生物一行与阿根廷卫生部长卡拉·维佐蒂进行会晤时,康希诺生物董事长、首席执行官宇学峰表示,未来将着眼于与当地制造商合作实现技术转让,并计划实现新冠疫苗从阿根廷向整个拉丁美洲供应。
2022年8月26日,太平洋联盟(Alianza del Pacífico)成员国智利、哥伦比亚、墨西哥、秘鲁以及观察员国厄瓜多尔五国驻华使节代表团到访康希诺生物。康希诺生物董事长、首席执行官宇学峰表示,康希诺生物一直以来十分注重与拉美国家的合作,特别是感谢各国政府与民众对公司的支持和信任。未来,康希诺生物还将一如既往的用先进疫苗技术来助力区域抗击疫情,并开展更多产业合作。
第三部分:疫苗公平
最新数据显示,截至2022年10月14日,高收入国家已经有80%的人口完成全程新冠疫苗的接种,但是低收入国家有超过75%的人口仍然没有接种第一针。
2021年7月22日世界卫生组织发布的《疫苗不公平现象会破坏全球经济》指出,根据联合国开发计划署(开发署)、世界卫生组织(世卫组织)和牛津大学今天发布的新数据,如果不采取紧急行动增加疫苗供应并确保每个国家都能公平获得,则COVID-19疫苗的不公平现象将对低收入和中低收入国家的社会经济复苏产生持久而深远的影响。
在新冠疫情依旧严峻的背景下,作为全球公共卫生产品,新冠疫苗仍是及早发现感染者或感染风险、阻止病毒传播扩散的有效武器。然而,新冠疫苗分配不公的现状依旧在持续,亟待重视并做出改变。
3.1 疫苗分配不公现状
Our World in Data数据显示,截至2022年12月23日,中国累计接种新冠疫苗34.7亿剂次。截至12月26日,印度22.0亿剂次,巴西4.80亿剂次,日本3.70亿剂次,俄罗斯1.83亿剂次,意大利1.43亿剂次,加拿大0.96亿剂次,智利0.63亿剂次。截至12月25日,法国1.53亿剂次。截至12月23日,德国1.90亿剂次。截至12月20日,美国累计接种新冠疫苗6.62亿剂次。截至12月8日,巴基斯坦3.02亿剂次。截至12月1日,越南2.65亿剂次。截至9月30日,泰国1.43亿剂次。
受到经济发展状况、医疗卫生状况、疫苗规模化生产能力差异等因素影响,不同收入的国家疫苗接种也存在明显差异。据Our World in Data官网数据,截至2022年12月27日,牛津大学Our World in Data统计全球累计报告接种新冠病毒疫苗130.9剂次,接种率68.7%。然而值得关注的是,低收入国家仅25.1%的人接种至少一剂疫苗。截至2022年12月26日,高收入国家每100人接种新冠疫苗220.80剂次,中高收入国家212.70剂次,中低收入国家137.42剂次。截至12月21日,低收入国家32.94剂次。

不同收入群体每百人接种新冠疫苗剂次 来源:Our World in Data官网
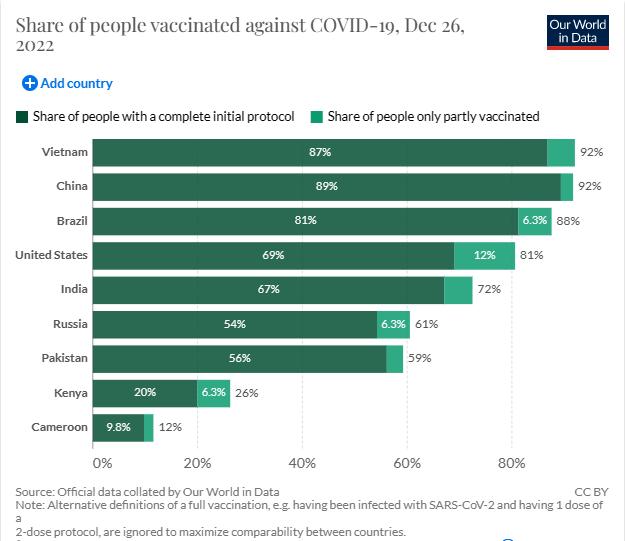
截至2022年12月1日,越南至少接种一剂新冠疫苗的人口比例为92.0%;截至12月20日,美国为80.8%;截至12月26日,俄罗斯为60.5%;截至12月8日,巴基斯坦为59.2%;截至12月26日,南非为37.6%;截至12月26日,尼日利亚至少接种一剂新冠疫苗的人口比例为29.3%,截至12月4日,喀麦隆为11.6%。
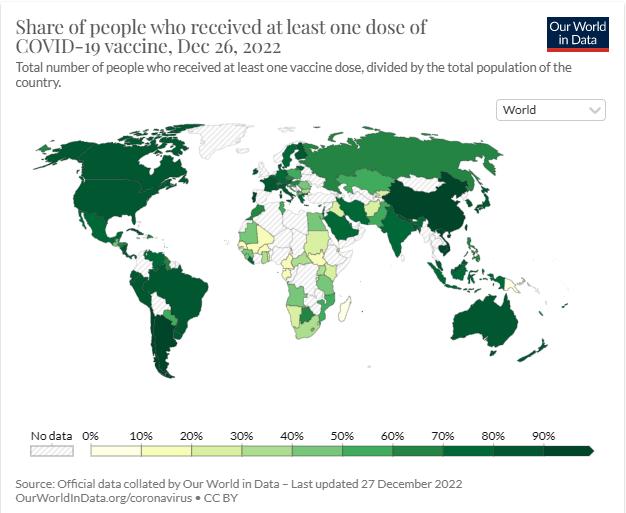
全球至少接种1剂次新冠疫苗的人口比例分布 来源:Our World in Data官网
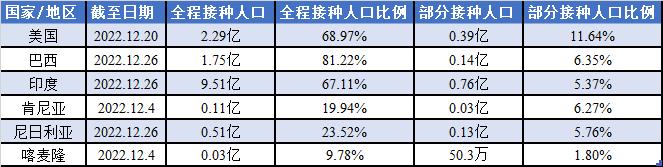
截至2022年12月20日,美国实现全程接种人口2.29亿,占总人口比例68.97%,部分接种人口0.39亿,占总人口比例11.64%。截至2022年12月26日,巴西实现全程接种人口比例1.75亿,占总人口比例为81.22%,部分接种人口0.14亿,占比6.35%。
相比之下,非洲部分国家的全程接种比例明显较低。截至2022年12月26日,尼日利亚全程接种人口0.51亿左右,占比23.52%;部分接种人口0.13亿左右,占比5.76%。截至2022年12月4日,喀麦隆全程接种人口273万,占比仅9.78%;部分接种人口50.3万左右,占比1.80%。
数据来源:Our World in Data官网
不同国家全程接种和部分接种新冠疫苗人口比例 来源:Our World in Data官网
2021年7月29日,由博鳌亚洲论坛研究院和中国人民大学重阳金融研究院合作完成的报告《全球新冠疫苗应用图景报告》(下称《报告》)在北京发布。《报告》指出,目前疫苗的国际分配存在着严重的不均衡和分化现象。在全程接种人口比例超过30%的国家当中,欧美国家占据了大多数。而欠发达国家和地区疫苗接种率普遍偏低,比如非洲大陆已接种的疫苗占全球不到2%。低收入国家只有0.9%的人口接种了至少一剂新冠疫苗。
《报告》认为,如何提高疫苗在发展中国家的可及性和可负担性,是当前国际社会在抗击疫情中面临的最突出问题。如今,医学界基本达成共识:实现全球普遍接种疫苗,是尽快结束新冠疫情大流行的唯一方法。
世卫组织总干事谭德塞也曾表示,要实现让全世界人口的70%接种疫苗的目标,世界需要110亿剂疫苗。全球新冠疫苗的总产能预计在2021年年底前基本能达到这一数量,问题在于疫苗能否在全球进行合理分配。
3.2 疫苗分配为何不公
当前新冠疫苗分配不公的现状与多重因素有关,包括部分国家或地区囤积疫苗、限制疫苗及疫苗原材料出口、疫苗价格,部分疫苗生产企业优先考虑商业利益而非社会利益,知识产权豁免受阻等。
3.2.1 囤积疫苗加大差距
“世界正处在‘灾难性道德沦丧’的边缘。”2021年1月18日,在世界卫生组织以视频方式召开的第148届执委会会议上,世卫组织总干事谭德塞痛批全球新冠疫苗分配不公的现状。谭德塞称,至少有49个高收入国家已经接种了超过3900万剂疫苗,而一个最低收入国家只得到25剂疫苗,“不是2500万剂,也不是2.5万剂,而是25剂”。
在全球公共卫生事件面前,以美国为例的一些国家采取的是优先供应本国且不与邻国分享的做法。据报道,2021年2月5日拜登政府宣布,将利用《国防生产法》(Defense Production Act)保证新冠疫苗的生产和供应,美国本地的疫苗生产企业将优先获得疫苗生产的原材料和关键设备,以保证能顺利交付疫苗。当地时间3月1日,时任美国白宫新闻秘书普萨基被问到总统拜登是否会考虑与邻国分享美国制备的新冠疫苗时,却给予明确否认,并表示疫苗会优先给所有美国人接种。
在世界多国的新冠疫苗短缺之际,美国囤积的新冠疫苗数量惊人。杜克大学全球健康创新中心追踪全球疫苗合同发现,2021年1月,美国已经抢购约26亿剂疫苗,约占全球总量1/4,是美国3.3亿人口需求量(按一人两剂计算)的近4倍。
3.2.2 限制疫苗及原材料出口
除了囤积新冠疫苗,原材料出口受限也会阻碍疫苗顺利生产,尤其对于急需新冠疫苗抗击疫情的发展中国家和欠发达国家而言。
2021年3月24日,作为阿斯利康、Novavax等公司数亿剂新冠疫苗的生产商,印度血清研究所(SII)首席执行官Adar Poonawalla向世界银行委员会表示,美国一项法律禁止出口某些关键物品,包括袋子和过滤器,这可能导致严重的生产瓶颈。
Poonawalla还强调,“这些关键原材料的共享将成为主要限制因素,到目前为止,没有人能解决这个问题。”印度制药企业认为美国此举违背了全球疫苗公平分享的方针,将对疫苗生产效率造成负面影响。印度血清研究所甚至公开向美国喊话称,“乞求”尽快解除禁令。
与此同时,受到2021年新一轮疫情冲击,为保障国内疫苗供应,印度宣布对疫苗出口予以限制。作为全球最大的疫苗生产商,印度血清研究所负责人2021年1月3日表示,在未来几个月内,印度政府将不允许该机构出口牛津大学与英国制药商阿斯利康联合研发的Covishield新冠疫苗。
除了印度,欧盟也曾对疫苗出口进行管制,这要追溯到与疫苗公司的争执。2021年1月,欧盟就疫苗供应问题与阿斯利康、辉瑞等疫苗企业产生矛盾。阿斯利康表示当年第一季度无法按照协议向欧盟供应8000万剂疫苗,只能供应3100万剂疫苗。阿斯利康首席执行官索里奥特表示,由于与欧盟的疫苗协议签订较晚,因此“没有足够时间”来解决疫苗生产问题。
延迟交付引起了多个欧盟国家的不满。当地时间1月28日,在欧盟委员会的要求下,比利时卫生部门前往位于本国的阿斯利康疫苗生产工厂进行调查,以查证阿斯利康产能不足的说法是否属实。
据环球时报消息,欧盟2021年3月24日公布了一份更严格的新冠疫苗出口管制规定,以阻止在欧盟境内的疫苗生产商向英国等接种率较高的国家出口新冠疫苗。根据新的规定,任何向其他国家出口新冠疫苗的在欧新冠疫苗生产商,必须获得欧盟的许可。出口禁令适用于所有在欧盟境内生产的疫苗,包括阿斯利康、辉瑞和莫德纳生产的疫苗。
3.2.3 部分疫苗厂商一味逐利
“疫苗不公平问题是结束这场大流行疫情并从COVID-19中复苏的最大障碍。”世卫组织总干事谭德塞表示,多数疫苗生产商将利润放在首位,绕过世卫主导的新冠肺炎疫苗实施计划(COVAX),优先向富国直接供应疫苗,这推高价格,导致市场混乱,使世卫的疫苗采购进程受阻。
有美国媒体曾发文章称,莫德纳为了获取利润优先向富有国家供应疫苗,而那些较穷的国家不但面临疫苗延期供应问题,其采购价格也高出富国。
据《财经》报道,自2020年以来,辉瑞把制造的78%、莫德纳将85%疫苗配送给了高收入国家,两家药企分别从中获利260亿和192亿美元。这令不少流行病学家感到愤怒,美国疾控中心前主任费和平(Tom Frieden)批评莫德纳的行为“完全没有责任感”。
对于其优先考虑商业利益而非传染病防治的考量,美国疾控中心前主任费和平(Tom Frieden)和许多传染病专家、疫苗专家均表示严厉谴责,费和平甚至发出警告,如果这两家药企不及时转移疫苗制造技术,数百万生命可能因为疫苗的不及时供应而逝去。
为此,谭德塞曾表示,制造商一定要优先处理COVAX和非洲联盟的订单,将这当作紧急要求,需要让配送更透明化。它们也一定要分享技术,给予生产许可证,如果它们这么做,我们就能终结疫情,加速全球复苏。
3.2.4 知识产权阻碍
知识产权成为阻碍部分发展中国家掌握疫苗制造与生产进程的重要因素之一。
2020年10月,南非和印度将一项涉及新冠的专利保护豁免提议提交给世贸组织《与贸易有关的知识产权协定(TRIPS)》理事会。约一个月后的理事会会议上,参与撰写提案的南非常驻世贸组织代表团参赞穆斯塔基姆•德加马表示,该提案将为更多生产商提供发展空间,“以确保我们能在更短时间内实现扩大疫苗产能”。南非认为,除非采取措施解除知识产权壁垒,否则会出现新冠疫苗生产和普及障碍。印度表示,某些西方国家正尽可能地抢占有限的疫苗供应,另一方面,这些国家反对豁免知识产权保护。
欧盟委员会主席冯德莱恩2021年5月7日强调,放弃专利不会在中短期内增加疫苗供应,美国等国家应该像欧盟一样增加出口。她说,欧盟生产的4亿剂疫苗中,有约50%的疫苗出口到90个国家。
中国对知识产权豁免始终持支持态度。2021年5月21日,在全球健康峰会上,中国宣布了支持全球团结抗疫的五项举措,其中包括中国支持本国疫苗企业向发展中国家进行技术转让,开展合作生产;中国已宣布支持新冠肺炎疫苗知识产权豁免,也支持世界贸易组织等国际机构早日就此作出决定。
3.3 如何解决疫苗分配不均
3.3.1 中国付诸实际行动,促进疫苗分配公平
面对全球疫苗分配不公的现实,中国在多次重要国际场合表明了自身立场和态度,并以实际帮助当地打造更具韧性的疫苗产品生产、供应和分发链条,从而更高效地获得新冠疫苗。
2020年5月18日晚,中国在第73届世界卫生大会提出,中国新冠疫苗研发完成并投入使用后,将作为全球公共产品,为实现疫苗在发展中国家的可及性和可担负性作出中国贡献。
2021年5月21日,中国在全球健康峰会上强调,要摒弃“疫苗民族主义”,解决好疫苗产能和分配问题,增强发展中国家的可及性和可负担性。疫苗研发和生产大国要负起责任,多提供一些疫苗给有急需的发展中国家,支持本国企业同有能力的国家开展联合研究、授权生产,还倡议设立疫苗合作国际论坛,由疫苗生产研发国家、企业、利益攸关方一道探讨如何推进全球疫苗公平合理分配等。
为践行让疫苗成为全球公共产品的承诺,中国始终以身作则,多次在重要国际场合做出承诺,持续不断地向发展中国家捐赠提供新冠疫苗。
2021年2月1日,中国政府向巴基斯坦捐赠的一批新冠病毒灭活疫苗运抵,据了解,这是中国政府对外提供的第一批疫苗援助。此后,中国对外疫苗援助持续不断,主要新冠疫苗产品生产企业包括国药集团、中国科兴、康希诺生物等。
据中国新闻社消息,2022年1月11日,74.68万剂援助缅甸的中国科兴新冠疫苗从中国昆明起运,运往缅北。据了解,这是中国向缅甸北部地区提供新一批100万剂科兴新冠疫苗援助计划的第一批次,第二批次25.32万剂疫苗拟于2月9日从北京启运,3月10日前分批出境并全部交付缅方。
国家国际发展合作署邓波清副署长出席中国政府援柬埔寨新一批新冠肺炎疫苗启运仪式时表示,截至目前,中方已向柬方提供了4200万剂疫苗,成为柬方最重要和最安全的疫苗供应国,助力柬方疫苗接种率位居东盟乃至世界前列。
当地时间2021年3月30日晚,首批康希诺生物新冠疫苗运抵巴基斯坦,为该国快速构建免疫屏障、早日恢复社会经济的正常运转助力。
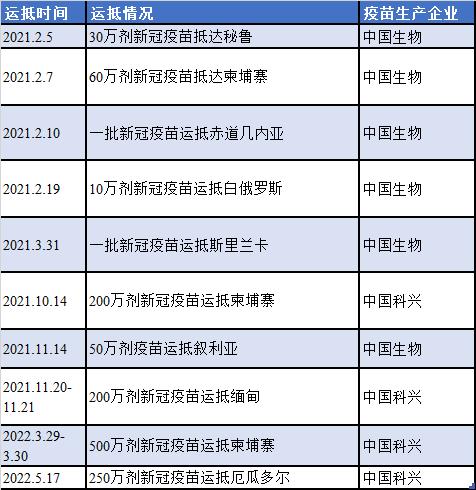
中国援外新冠疫苗情况统计(部分)资料来源:“中国生物”“疫苗之益”等微信公众号 制表:21世纪经济报道
2022年9月29日,中宣部举行“中国这十年”系列主题新闻发布会,介绍新时代外交有关工作。外交部副部长马朝旭表示,疫情以来,中国同180多个国家和国际组织分享疫情防控和诊疗方案,向34个国家派出38支医疗专家组,向120多个国家和国际组织提供超过22亿剂疫苗。
2021年9月3日,在中国政府向缅甸援助新一轮新冠疫苗及抗疫物资交付仪式上,国家国际发展合作署副署长邓波清介绍称,目前中国已向34个国家派出了37支医疗专家组,已向150个国家和13个国际组织提供防疫物资援助。同时中国坚持人类命运共同体理念,组织了近千场抗疫经验视频交流会。另外,数据显示,截至2022年5月上旬,中国已累计向153个国家和15个国际组织提供了46亿件防护服、180亿人份检测试剂、4300余亿个口罩等抗疫物资。
在6月9日线上举行的第二十八期盖茨基金会全球健康与发展媒体研讨班上,全球疫苗免疫联盟CEO塞斯•伯克利介绍指出,目前,中国已经有2.28亿剂新冠疫苗通过COVAX输送到50个国家,为解决2021年全球新冠疫苗供应紧张的问题起到关键作用。基于像中国这样的捐赠国的支持,以及像科兴、国药这类疫苗生产商的支持,目前COVAX已经向146个国家和地区提供了15亿支新冠疫苗。此外,中国还承诺提供1亿美元来支持COVAX预先市场承诺机制(AMC),该机制帮助全世界92个低收入国家采购疫苗。
据了解,为缩小发达国家与发展中国家之间的免疫鸿沟,全球疫苗免疫联盟(GAVI)、世卫组织和流行病预防创新联盟(CEPI)共同组建了新冠肺炎疫苗实施计划(COVAX),旨在提高疫苗研制效率,为疫苗的快速生产和全球普及奠定基础。
2020年10月,中国宣布加入新冠疫苗实施计划,承诺供应1000万剂疫苗。当地时间2021年7月12日,全球疫苗免疫联盟宣布,中国国药集团和中国科兴分别与“新冠肺炎疫苗实施计划”签署供应疫苗的合作协议。两家企业将于7月起向COVAX提供疫苗,用于发展中国家的新冠肺炎疫情防控。截至2021年11月12日,中国已向COVAX供应超过7000万剂疫苗,并同19个发展中国家开展疫苗联合生产。2022年2月中旬,中国常驻日内瓦代表陈旭同全球疫苗免疫联盟首席执行官伯克利在日内瓦签署协议,向“新冠疫苗实施计划”捐赠1亿美元,用于向发展中国家分配新冠疫苗。
3.3.2 各方达成共识,共同生产全球公共产品
联合国开发计划署(开发署)署长阿希姆•施泰纳曾表示:“在一些低收入和中等收入国家,只有不到1%的人口接种了疫苗,这促使我们沿两条轨道从COVID-19大流行中实现复苏。现在是迅速采取集体行动的时候了。
对于作为全球公共产品的新冠疫苗,如何实现分配公平?在上述研讨会上,中国农业大学教授李小云建议,中国政府、盖茨基金会等各方达成未来的发展共识,共同开展公共产品的生产。具体而言有以下三点:
第一,需要加强多边机构和各国政府、公民社会以及全社会之间的共识,以此支持政府的行动和公民社会的行动,私营部门的行动都要尽最大的可能与地缘政治脱钩。
第二,在健康、减贫、气候变化等关键领域,建立一个新的、精简的、去官僚化的发展机制,在保证自身合法性的基础上可以迅速响应突发性全球危机,保证质量控制,及时调动资源。
第三,需要更大程度地挖掘现代技术的创新能力。现代技术即数字化,可以提供大量的信息,解决一些现代的问题。
与此同时,塞斯•伯克利表示,在抗体层面,疫苗帮助减少感染或者降低传播的效果相对一般,因此疫苗面对奥密克戎传染力的保护下降,导致一些国家出现新一波的传染。如果病毒变异到目前的疫苗不能避免重症和死亡时,COVAX必须要投资新的疫苗。
对于疫苗的分配机制,塞斯•伯克利指出,由于供应非常短缺,Gavi在世卫组织中设立了特定的新冠疫苗分配机制。该机制拥有独立的理事会,使用数学模型尽可能有效地分配疫苗,同时还取决于成员国需要哪种疫苗、此前是否已经接受过疫苗以及疫苗的接种率等。疫苗分配过程中要尽可能公平和随机,同时也尽量减少浪费,现在疫苗供应主要取决于国家的需求,判断各国的疫苗储存能力、已经拥有的疫苗数量以及疫苗接种时间表。
Gavi如何确定疫苗的优先级进行推广,如何体现公平性?塞斯•伯克利介绍称,针对疫苗的优先级设定,Gavi依据的是疫苗投资策略(Vaccine Investment Strategy),每五年会了解科学界研究的所有疫苗,然后根据疾病的负担、疫苗的成本效益、疫苗生产的难易程度,来确定疫苗的优先顺序。但对于传染性疾病暴发采取了一个特殊的机制。Gavi理事会的共识是,只要有疫情出现,就把已有的疫苗拿来进行比较,但评判标准要简单得多,比如对疫苗有效性的评估和整体进展等。
指导:南方财经全媒体集团
出品:21世纪经济报道 21世纪新健康研究院
统筹:于晓娜、朱萍
策划:朱萍
执行:朱萍、武瑛港 实习生 林昀肖 李佳英
编辑:徐旭 季媛媛

















