这里是《21健讯Daily》,欢迎与21世纪经济报道新健康团队共同关注医药健康行业最新事件!
一、政策动向
●国家药监局:6家化妆品生产企业飞检违规
9月8日,国家药监局发布关于广州总都国际生物科技有限公司等企业飞行检查结果的通告(2023年第44号)。
近期,国家药监局组织对广州总都国际生物科技有限公司、亿通生物科技(广州)有限公司、汕头市玉洁化妆品有限公司、广州市秀语化妆品有限公司、广州市妆妍生物技术有限公司、广州赫兰迪生物科技有限公司6家化妆品生产企业进行了飞行检查。经查,发现上述企业违反了《化妆品监督管理条例》《化妆品生产质量管理规范》等有关规定。上述企业已对存在的问题予以确认。为保障公众用妆安全,国家药监局要求广东省药品监督管理局对企业上述涉嫌违法行为依法予以处理。广东省药品监督管理局目前已责令上述企业暂停生产、经营并进行整改,同时对其立案调查。
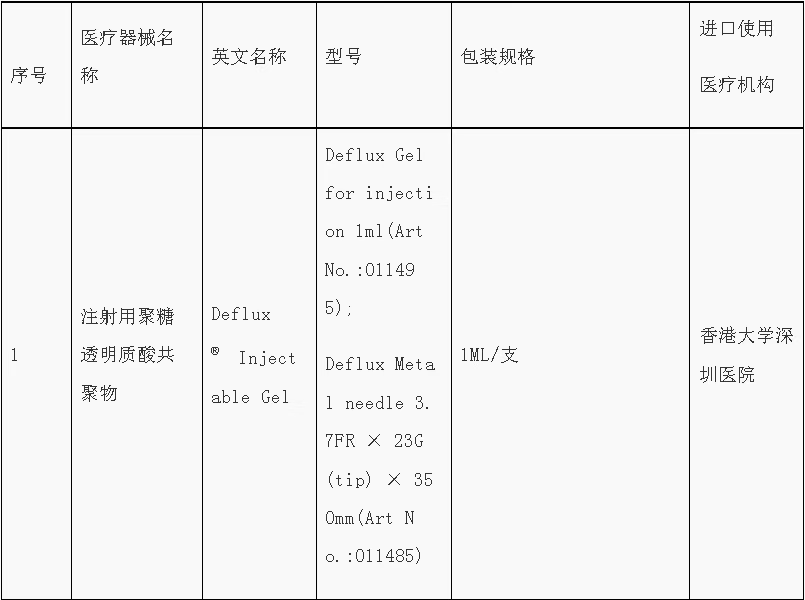
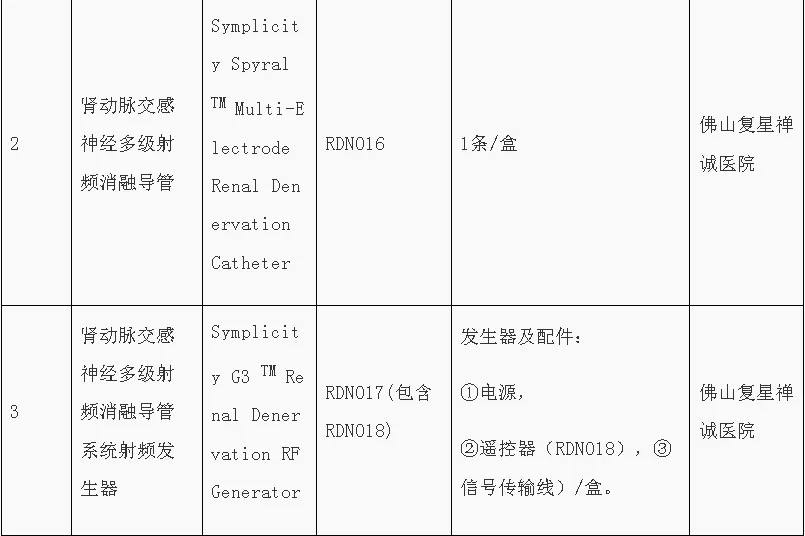
●第五批“港澳药械通”目录发布
9月8日,根据《粤港澳大湾区药品医疗器械监管创新发展工作方案》(国市监药〔2020〕159号)和《广东省粤港澳大湾区内地临床急需进口港澳药品医疗器械管理暂行规定》(粤药监规许〔2021〕4号)要求,结合工作实际,广东省药品监督管理局、广东省卫生健康委员会发布第五批粤港澳大湾区内地临床急需进口港澳药品医疗器械目录。



●《关于支持在横琴粤澳深度合作区使用澳门地区已上市部分药品的工作方案》发布
9月8日,广东省药品监督管理局、广东省发展和改革委员会、广东省卫生健康委员会、中华人民共和国海关总署广东分署联合发布关于印发《关于支持在横琴粤澳深度合作区使用澳门地区已上市部分药品的工作方案》的通知。
方案指出,按照《中华人民共和国药品管理法》《横琴粤澳深度合作区建设总体方案》《粤港澳大湾区药品医疗器械监管创新发展工作方案》《广东省粤港澳大湾区内地临床急需进口港澳药品医疗器械管理暂行规定》等有关规定,在合作区内允许澳门居民使用澳门地区已上市部分药品,进一步推动粤澳两地医疗和用药等民生公共服务衔接,有效拓展澳门居民优质生活空间。
一是适用范围。关于医疗机构范围:适用于合作区内为澳门居民提供基础医疗服务的指定医疗机构。关于使用药品品种范围:适用于除生物制品外的已在澳门地区上市的部分药品(以下简称指定澳门药品,指定澳门药品不含实施进出口准许证管理的麻醉药品、精神药品、兴奋剂目录中的蛋白同化制剂和肽类激素、药品类易制毒化学品、放射性药品等品种)。指定澳门药品实行目录管理,药品目录由广东省药品监督管理局(以下简称省药监局)、广东省卫生健康委员会(以下简称省卫生健康委)会同澳门药品监管部门审核确定并动态调整。
二是相关要求及流程。省卫生健康委根据指定医疗机构申请或者合作区卫生健康部门推荐,负责审核为澳门居民提供基础医疗服务的指定医疗机构。
合作区内指定医疗机构向省药监局提出指定澳门药品申请,并提交经澳门药品监管部门审核确定后的用药清单,经广东省药监局和广东省卫生健康委批准后,可以在合作区内指定医疗机构中提供给澳门居民使用。
三是监督管理。广东省药监局按照粤澳双方签订的《粤港澳大湾区药品医疗器械监管协作备忘录》,加强与澳门特别行政区政府药品监管部门合作,指导合作区药品监督管理部门开展监管工作。合作区卫生健康部门依法对指定医疗机构的诊疗行为进行日常监管。合作区药品监督管理部门依法对指定澳门药品在合作区内运输、贮存、经营等过程进行日常监管。同时,加强与澳门特别行政区政府药品监督管理部门衔接,通过建立合作机制、签订备忘录等方式,实现药品安全信息互通共享,制定应急处置协作机制,加强对指定澳门药品的全生命周期安全管理。
二、药械审批
●百拓维®(戈舍瑞林微球)在中国获批乳腺癌适应症
9月7日,百济神州与绿叶制药集团宣布,绿叶制药自主研发的创新制剂注射用戈舍瑞林微球(中文商标:百拓维®)已获得中国国家药品监督管理局(NMPA)批准,用于可用激素治疗的绝经前期及围绝经期妇女的乳腺癌患者。
自今年6月30日百拓维®在中国获批用于前列腺癌的治疗以来,百济神州便与绿叶制药携手,快速开启该产品惠及患者的整体进程,第一时间投入临床使用。此次新适应症的获批,意味着百拓维®覆盖的患者群体将进一步扩大。
●抗癌新药“米托坦片”在中国获批上市
9月8日,中国国家药品监督管理局(NMPA)官网最新公示,HRA Pharma Rare Diseases公司的米托坦片(mitotane)已在中国获批上市。根据优先审评公示信息,该药本次获批的适应症为肾上腺皮质癌(ACC)。
米托坦是一种肾上腺细胞毒性活性物质,可抑制肾上腺皮质产生皮质类固醇激素。对米托坦作用方式的研究发现,该药有两个主要的生物学效应:一是通过线粒体改变和抑制甾醇-O-酰基转移酶1(SOAT1)的活性,米托坦可对肾上腺皮质细胞产生直接的细胞毒性作用;二是通过改变皮质醇的外周代谢并直接抑制肾上腺皮质分泌皮质类固醇,来抑制皮质类固醇的合成。
●蓉生药业重组凝血因子Ⅷ正式获批
9月8日,中国国家药品监督管理局(NMPA)官网最新公示,由天坛生物子公司蓉生药业申请的注射用重组凝血因子Ⅷ已正式获批。公开资料显示,该产品拟开发用于治疗血友病A患者。
公开资料显示,血友病A是一种由凝血因子Ⅷ(Coagulation Factor Ⅷ,FⅧ)缺乏而导致的出血性疾病,是X染色体连锁的隐性遗传性疾病,主要由凝血因子Ⅷ基因突变引起。若反复出血不及时治疗,可导致关节畸形和(或)假肿瘤形成,严重者可危及生命。
三、资本市场
●沙砾生物完成4亿元B轮融资
9月8日,沙砾生物(Grit Biotechnology)宣布完成4亿元 的B轮融资,本轮融资由中金资本旗下基金领投,前海方舟、联东投资、源禾资本、禾方田合伙企业以及原股东夏尔巴投资、德诚资本、经纬中国跟投。
本轮融资将用于支持其肿瘤浸润淋巴细胞(TIL)疗法管线的开发,包括GT101的关键临床试验以及多项下一代基因编辑型TIL管线的开发,致力于为全球实体瘤患者打造开创性细胞药物。
四、行业大事
●北京首次“DGR+集采”联动中选结果公布
近日,北京市医保局官网公布了该市《第一批DRG付费和带量采购联动 管理采购产品中选结果》。
北京市DRG付费和带量采购联动,由安贞医院、积水潭医院、天坛医院、阜外医院、北医三院、宣武医院等6家三甲医院组成的DRG联动采购集团牵头,联合北京市公立医疗机构组建联盟,针对运动医学类、神经介入类、电生理类医用耗材,制定了DRG付费和带量采购联动管理方案。其中,1号公告针对神经介入类弹簧圈产品(包括但不限于以国家医保耗材编码C020516065前10位开头),采取带量联动方式;2号公告针对上市运动医学类、神经介入类、电生理类医用耗材产品采取带量谈判方式,其中“颅内支架-覆膜支架”只进行价格谈判不带量。尽管采购方式不同,但全市医保定点医疗机构均可作为采购主体参加本次DRG联动采购。采取带量谈判的产品,按照国家医保医用耗材分类与代码前10位分别确定电生理、运动医学、神经介入三类医用耗材采购产品。


















